Un test de sangre para detectar alzheimer, el gran avance que valida la FDA
La Administración de Alimentos y Medicamentos de Estados Unidos aprobó por primera vez una prueba sanguínea para detectar indicios tempranos del Alzheimer en pacientes con deterioro cognitivo. La herramienta promete transformar el diagnóstico temprano de la demencia más común en el mundo.
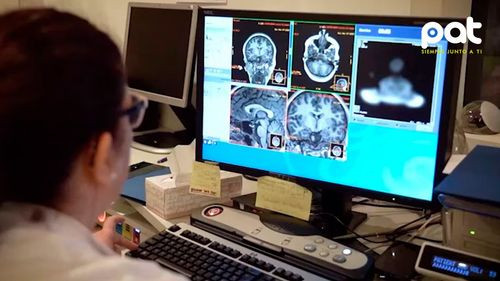
Un nuevo capítulo en la lucha contra el Alzheimer comenzó a escribirse en Estados Unidos. La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) aprobó el uso de un test de sangre in vitro que permite detectar señales tempranas de esta enfermedad neurodegenerativa en pacientes con síntomas de deterioro cognitivo. El avance representa un hito en el diagnóstico de la forma más frecuente de demencia, que, según la Organización Mundial de la Salud, representa entre el 60% y el 70% de los casos a nivel global.
La prueba, denominada Lumipulse G pTau 217/β-Amyloid 1-42 Plasma Ratio, fue desarrollada por la compañía Fujirebio y ya está disponible en los laboratorios clínicos estadounidenses. Su implementación permitirá a los médicos detectar la enfermedad sin recurrir en primera instancia a estudios invasivos como la punción lumbar o los escáneres cerebrales.
Este test está indicado exclusivamente para adultos mayores de 50 años que presenten signos de deterioro cognitivo y estén siendo evaluados por profesionales especializados. A través del análisis de dos proteínas clave que circulan en la sangre —pTau 217 y beta amiloide 1-42—, el test puede predecir la presencia de placas amiloides en el cerebro, consideradas un sello distintivo del Alzheimer.
En un estudio clínico con 499 pacientes, la prueba mostró un valor predictivo positivo del 92% y un valor predictivo negativo del 97%, consolidándose como una herramienta confiable. La FDA también le otorgó la categoría de “dispositivo innovador”, lo que reconoce su potencial para cubrir una necesidad médica insatisfecha y acelerar su aplicación clínica.
La directora del Centro de Dispositivos y Salud Radiológica de la FDA, Michelle Tarver, destacó que la aprobación “facilita el acceso más temprano a esta herramienta para los pacientes en Estados Unidos”.

Expertos como el neurólogo Ricardo Allegri, del Fleni, y Fernando Cáceres, del Instituto de Neurociencias Restaurativas, coinciden en que el uso de biomarcadores en sangre representa el futuro del diagnóstico de Alzheimer. Actualmente, los métodos disponibles incluyen análisis de líquido cefalorraquídeo y neuroimágenes, pero estos son más costosos, invasivos y menos accesibles.
Según los especialistas, el Alzheimer afecta las neuronas del hipocampo, lo que provoca una pérdida progresiva de la memoria reciente. En etapas avanzadas, compromete otras funciones cognitivas y altera la vida social e independencia de los pacientes.
En EE. UU. se estima que más de 7,2 millones de personas viven con Alzheimer, y esa cifra podría duplicarse hacia 2060. La validación de esta prueba ofrece una esperanza para reducir los tiempos de diagnóstico y mejorar el acceso a tratamientos adecuados.
Aunque la prueba no reemplaza completamente los métodos tradicionales, sí puede actuar como un filtro inicial que ayude a los médicos a tomar mejores decisiones clínicas. Al ser una herramienta menos invasiva y de más bajo costo, marca un cambio de paradigma en el abordaje de las enfermedades neurodegenerativas.
La comunidad científica y las organizaciones de pacientes han recibido la noticia con entusiasmo. El diagnóstico precoz, aunque no implica una cura, permite planificar mejor los cuidados, iniciar tratamientos tempranos y brindar mayor calidad de vida a quienes enfrentan esta devastadora enfermedad.
Noticias relacionadas
- Servicio Departamental de Salud de Santa Cruz critica al Ministerio por falta de apoyo ante crisis hospitalaria
- Colegio Médico cruceño pide gran minga y más vacunas ante aumento de chikungunya e influenza
- Confirman 70 casos de chikungunya en el norte paceño
- Centros de salud paceños agotan vacunas contra la influenza
- Denuncian 14 ventiladores en desuso y solo seis operativos en el Hospital de Clínicas